Introduction : le rôle des infections associées aux soins de santé
La pandémie de grippe (H1N1) en 2009, la menace du virus Ebola en Afrique de l’Ouest en 2014, et le Covid-19 en 2020 montrent que les menaces internationales à travers de nouvelles infections peuvent émerger à tout moment. En particulier, la pandémie de COVID-19 a posé un défi sans précédent à la santé publique, il a souligné la nécessité d’investir dans les systèmes de santé, d’être prêt à gérer les urgences sanitaires mondiales et, éventuellement, à les prévenir.
Non seulement les maladies infectieuses représentent la principale cause de crise mondiale, mais elles demeurent la principale cause de décès dans le monde, en particulier dans les pays à faible revenu et chez les jeunes enfants.
En 2019, deux maladies infectieuses – les infections des voies respiratoires inférieures et les maladies diarrhéiques – ont été classées parmi les dix principales causes de décès dans le monde par l’Organisation mondiale de la santé (OMS)1.
Parallèlement aux infections acquises dans la collectivité, des infections associées aux soins de santé (IAH) sont apparues au cours des dernières années. Les IAS sont les infections que les patients contractent lorsqu’ils reçoivent des soins de santé » 2.
Depuis de nombreuses années, la propagation des infections est étroitement surveillée par des organismes nationaux et internationaux spécifiques tels que le Centre for Disease Prevention and Control (CDC) en Amérique et en Europe (ECDC), avec pour mission d’identifier, d’évaluer et de communiquer les menaces actuelles et émergentes pour la santé humaine posées par les maladies infectieuses.
Grâce à ces systèmes de surveillance, les IAH les plus fréquentes signalées en Europe sont bien connues et rapportées ci-dessous3 :
Infections des voies respiratoires (pneumonie à 21,4 % et autres infections des voies respiratoires inférieures à 4,3 %).
- Infections urinaires (18,9 %).
- Infections au site chirurgical (18,4 %).
- Infections de la circulation sanguine (10,8 %).
- Infections gastro-intestinales (8,9 %),
avec une infection à Clostridium difficile représentant 44,6% de ces derniers (4,9% de tous les HAI).
Au cours des dernières décennies, de nombreux hôpitaux ont mis en place des programmes de surveillance et de suivi, ainsi que des stratégies de prévention robustes, pour réduire le taux d’IAH. Les infections nosocomiales sont souvent liées à des infections résistantes aux antibiotiques, et, pour cette raison, elles ont un impact non seulement sur les individus, sur un seul patient, mais aussi sur les communautés locales où cet individu appartient.
La résistance aux antimicrobiens (RAM) fait référence à la capacité des micro-organismes à résister aux traitements antimicrobiens 4). L’usage excessif, la mauvaise utilisation et l’auto-administration d’antibiotiques (en particulier en Italie qui se classe au premier rang en Europe avec la Grèce pour les décès dus à la résistance aux antibiotiques 5) ont été liés à la propagation de micro-organismes qui leur résistent, rendant le traitement inefficace et posant un risque grave pour la santé publique.
Malgré de nombreuses alarmes émises par l’OMS et de multiples campagnes internationales mises en place dans le monde, le nombre de décès dus à la résistance aux antibiotiques a augmenté et augmentera chaque année pour atteindre 10 millions/chiffre de décès par an en 20506.
Le problème est que les bactéries deviennent non seulement résistantes aux antibiotiques, mais qu’elles sont également capables de transférer la résistance aux futures populations bactériennes. Cela signifie que la population de bactéries résistantes croît si rapidement que les agents pathogènes résistants s’étendent rapidement aux environnements liés à l’homme (tels que les aéroports, les transports publics, les écoles, les lieux de travail, les gymnases, etc.).
Pour les infections causées par des bactéries, il semble clair que la solution ne peut pas être recherchée en augmentant l’utilisation de nouveaux antibiotiques mais en élaborant un plan et des lignes directrices complets pour la prévention des IAS, des systèmes de diagnostic plus efficaces et plus opportuns, tant dans les établissements de santé qu’à domicile.
Les soins à domicile sont une ressource possible ?
Le transfert des patients des soins hospitaliers aux soins à domicile aurait une série d’effets positifs, tels qu’une moindre propagation des maladies infectieuses dans l’environnement, une réduction du risque de contracter des infections par des patients déjà affaiblis par des maladies chroniques, une plus grande disponibilité d’installations cliniques pour les patients qui ont particulièrement besoin d’être hospitalisés et, enfin, une réduction des coûts pour les systèmes de soins de santé|||UNTRANSLATED_CONTENT_START|||7.|||UNTRANSLATED_CONTENT_END|||
Déjà au début de 2000, plusieurs initiatives de télésurveillance des patients ont été publiées pour soutenir la capacité de traiter les patients à domicile dans le but d’améliorer l’efficacité du traitement et le résultat associé 8. Au cours des années suivantes, l’intégration d’informations cliniques non homogènes dans les flux de travail des soins de santé a commencé par l’adoption croissante de normes d’interopérabilité des données et des processus 9, conduisant au scénario actuel où, comme décrit dans le chapitre suivant, les technologies numériques modernes de la santé pourraient apporter une impulsion sensible aux soins à domicile.
Cette section décrit trois scénarios de soins à domicile où les technologies numériques déjà disponibles aujourd’hui sont intégrées dans la prise en charge des patients chroniques. Les programmes de soins à domicile ainsi que les outils numériques peuvent aider les professionnels de la santé à surmonter les aspects critiques qui pourraient survenir lors du déplacement des patients chroniques de l’hôpital vers le territoire, et qui pourraient limiter (voire empêcher) l’application de soins à domicile.
Notre expérience se concentre principalement sur la nutrition parentérale à domicile (HPN), la dialyse péritonéale (PD) et l’antibiothérapie parentérale ambulatoire (OPAT), mais il existe de nombreux autres domaines thérapeutiques où les soins à domicile sont applicables aujourd’hui et encore plus rapidement.
Nutrition parentérale à domicile
La nutrition parentérale (PN) est une thérapie vitale fournie par l’administration intraveineuse (IV) de nutriments (tels que les acides aminés, le glucose, les lipides, les électrolytes, les vitamines et les oligo-éléments), à l’extérieur du tractus gastro-intestinal. La nutrition parentérale totale (NPT) est lorsque la nutrition administrée par voie intraveineuse est la seule source de nutrition que le patient reçoit.
Les principaux effets indésirables associés à la NP peuvent être dus à des anomalies métaboliques, à un risque d’infection ou à un accès veineux associé10.
La transition de la nutrition parentérale hospitalière à la nutrition parentérale basée sur le territoire peut limiter/prévenir l’exposition du patient aux infections nosocomiales, mais peut également poser des risques importants et des vulnérabilités supplémentaires du patient si celles-ci ne sont pas systématiquement surveillées et traitées.
Par conséquent, les avantages thérapeutiques de HPN peuvent être entravés par des complications et des événements indésirables qui pourraient être évités par ailleurs 11.
La façon dont les organismes de santé mettent en œuvre la continuité des soins a un impact important sur la sécurité des programmes HPN.
Les risques pour la sécurité du patient au moment de son congé peuvent être élevés et pourraient entraîner un taux élevé de retour à l’hôpital12. Cependant, ces problèmes peuvent être évités en adoptant des stratégies adéquates et des protocolesclairs13. Souvent, les problèmes critiques qui déterminent la réadmission du patient augmentant le risque pour sa sécurité sont les conséquences directes d’un manque de coordination entre les systèmes territoriaux et hospitaliers. Ces criticités provoquent des interruptions dans la circulation, la gestion et la coordination de l’information 14.
Les technologies numériques modernes (figure 1) permettent la mise en œuvre de processus automatisés grâce à l’introduction de plateformes web pour la coordination des activités fournies au domicile du patient (par exemple, l’assistance infirmière, les matières premières, le partage de données cliniques) et la gestion de situations inattendues avec la participation éventuelle de cliniciens hospitaliers et/ou de personnel externe.
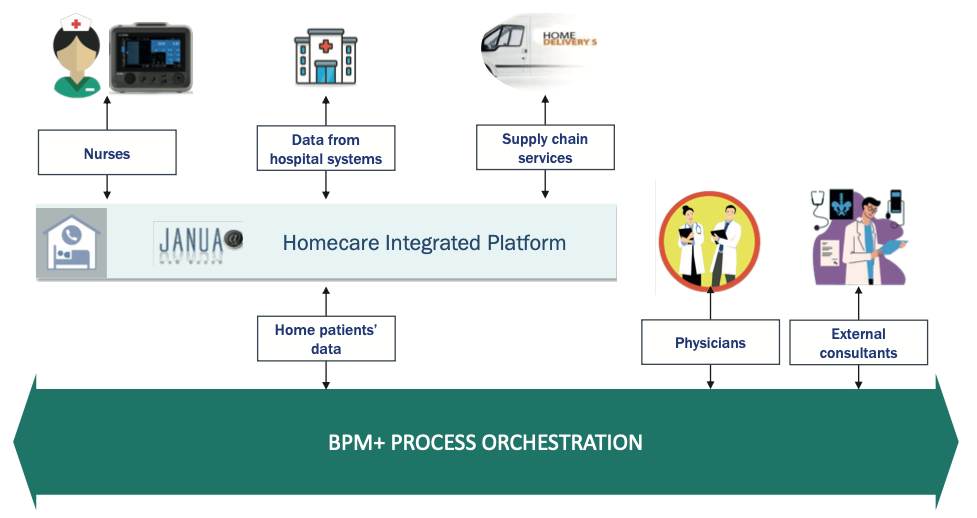
Fig. 1. Technologies numériques à l’appui du programme de soins à domicile en nutrition parentérale.
Un service HPN efficace et efficient ne peut être fourni qu’en mettant en œuvre une coordination constante et opportune de toutes les activités allant de la prise en charge du patient à l’approvisionnement en matières premières et à la gestion administrative connexe de l’ensemble du processus.
L’adoption d’une plateforme web conçue pour soutenir ce processus permet de :
- Gérer le continuum de soins en temps réel.
- Partagez des informations lors de la transition de l’hôpital à la maison et vice versa.
- Assurer une prise en charge intégrée et idéale des patients.
- Surveiller la performance de la prestation fournie.
Dialyse péritonéale
En plus des avantages déjà abordés découlant du cadre de soins à domicile, la possibilité de gérer les patients atteints d’une maladie rénale chronique subissant des thérapies de remplacement rénal à domicile avec dialyse péritonéale (PD) est une ressource précieuse qui permet aux patients de mener une vie quasi normale.
L’évolution rapide de la technologie numérique ouvre maintenant les portes à de nombreuses opportunités telles que la surveillance à distance des patients (RPM) tout en effectuant la MP à la maison avec les dernières générations de cyclistes PD (dialyse péritonéale automatisée – APD)15.
Pendant l’APD, le RPM avec capteurs sans fil permet une acquisition constante des données biométriques du patient à partir du cycler pendant toute la durée du traitement (Figure 2). Le personnel de santé (médecins spécialisés et infirmières de la SP) peut être affecté et autorisé à accéder à ces données via PC/tablettes/téléphones pour surveiller les traitements des patients à tout moment, de partout.

Fig. 2. Architecture de système APD.
Les cyclistes de nouvelle génération aujourd’hui assignés au patient à la maison, peuvent communiquer de manière autonome avec l’hôpital (où siège le centre clinique opérationnel) et permettre la collecte des données du patient à la fin de chaque traitement APD individuel.
Les données collectées auprès du patient, à la fois biométriques et liées au traitement APD, sont constamment analysées par le système et peuvent être transformées en alarmes/alertes aux professionnels de santé responsables de la gestion du patient.
Les médecins et les infirmières peuvent vérifier à distance les données des patients et décider de modifier le schéma posologique/la prescription à distance, si nécessaire.
L’impact de l’adaptation des traitements/prescriptions médicales à distance peut augmenter l’observance du patient, optimiser les résultats des patients et améliorer la sécurité des patients.
En outre, en évitant les accès multiples des patients à leur hôpital de référence pour revoir/changer les traitements, a le potentiel de réduire le fardeau ressenti par les familles fournissant des soins à domicile, d’améliorer l’observance du traitement, et par des boucles de rétroaction en temps réel pour améliorer les connaissances grâce à une éducation individualisée.
Thérapie antibiotique parentérale ambulatoire
Le concept de thérapie antibiotique parentérale ambulatoire (OPAT) né au début des années 1980 aux États-Unis dans le but de réunir une réduction des coûts et une amélioration de la qualité de vie du patient résultant d’un séjour hospitalier plus court, et d’un environnement plus accueillant et plus confortable autour du patient16
Toutefois, pour que l’OPAT soit réalisé indépendamment par le patient, les étapes suivantes doivent être garanties :
- La justesse du dosage du médicament et de ses composants.
- Absence de contamination environnementale.
- Taux d’administration correct.
Aujourd’hui, il est possible de gérer l’OPAT par un processus à domicile (Figure 3) et l’adoption de technologies biomédicales modernes.
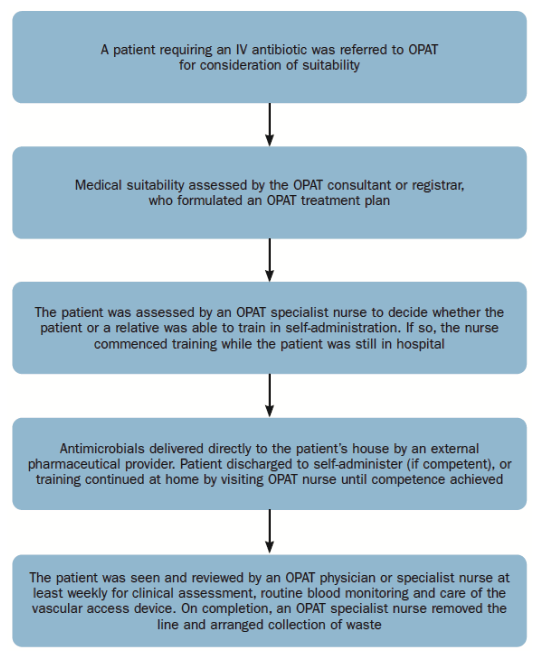
Fig. 3. Processus OPAT à domicile
Avec l’utilisation de ces technologies innovantes, les patients/ soignants qui ne sont pas en mesure de mélanger les antimicrobiens de la manière traditionnelle, peuvent être formés à l’utilisation de dispositifs élastomères à remplissage aseptique prémélangés par des fournisseurs pharmaceutiques externes.
En utilisant des dispositifs de perfusion continue de 24 heures, les antibiotiques bêta-lactamines tels que la flucloxacilline, la benzylpénicilline et la pipéracilline avec le tazobactam peuvent être auto-administrés par les patients eux-mêmes, évitant l’hôpital pendant la durée du traitement.
Les patients âgés ou présentant des problèmes de dextérité, les patients suivant des schémas thérapeutiques complexes et multi-médicaments et ceux pour lesquels les antibiotiques bêta-lactamines continus étaient le traitement préféré peuvent maintenant être déshospitalisés en leur fournissant un dispositif élastomère, qui contient un « ballonnet » élastomère : comme celui-ci se dégonfle au fil du temps, il pousse doucement l’antimicrobien à travers l’ensemble de perfusion intraveineuse qui transporte le médicament du dispositif au cathéter/port, fournissant un débit fiable et précis.
Technologies de santé numériques actuelles et futures pour la gestion des infections
Les technologies numériques modernes sont des ressources précieuses pour lutter contre la propagation des infections et soutenir la transition de l’hôpital au domicile du patient.
La mise en place d’appareils numériques à la fois en milieu hospitalier et à domicile, peut :
- Faciliter l’identification précoce du risque d’infection et permettre une intervention rapide du personnel médical et infirmier.
- Permettre une gestion plus prudente des antibiotiques à large spectre, prévenir plus efficacement la résistance aux antibiotiques et améliorer le type et les doses de la bonne thérapie antimicrobienne.
- Maximiser la biosécurité environnementale.
- Garantir la gouvernance des services thérapeutiques fournis sur le territoire, grâce à un suivi des performances en temps réel.
Quelques exemples de ces technologies sont décrits dans les paragraphes ci-dessous.
Plateforme Web pour la surveillance des infections
Jusqu’à il y a quelques années, les activités de surveillance des infections étaient menées par des équipes médicales interdisciplinaires qui analysaient les données extraites de divers systèmes d’information hospitaliers comme, par exemple, le dossier médical électronique et/ou le système d’information de laboratoire (lis).
Aujourd’hui, l’urgence sanitaire liée aux infections hospitalières causées par la résistance aux antibiotiques met l’accent sur les équipes de surveillance de la santé, qui ont accru la nécessité d’une extraction automatisée et plus fréquente d’un nombre croissant de données cliniques non homogènes.
Les fournisseurs de systèmes d’information médicale sont à la traîne sur l’innovation en matière de surveillance des infections, ce qui a conduit de nombreuses organisations de santé à se doter d’outils spécifiques de surveillance et de contrôle avancé des infections 17.
Une plateforme spécifique de surveillance des infections doit être en mesure de collecter de manière transparente des données à partir de tout système d’information existant au sein d’une organisation de soins de santé : registre d’admission, de sortie et de transfert de patients, laboratoire de microbiologie, salles d’opération, équipement médical, radiologie, etc.
Les données collectées sont traitées par des algorithmes capables de détecter immédiatement les risques potentiels tels que :
- La présence, dans un délai déterminé, de deux cas ou plus d’un microorganisme infectieux détecté chez des patients hospitalisés dans la même salle.
- La réadmission d’un patient qui a eu une infection grave au cours de la dernière année.
En cas de scénarios de risque potentiel d’infection, le personnel de surveillance est avisé rapidement afin que les précautions appropriées puissent être prises pour prévenir l’apparition de grappes épidémiques.
En outre, ces systèmes peuvent également fournir un soutien valable dans la gérance des antimicrobiens. Par exemple, la prescription d’un antibiotique à large spectre pourrait être rapidement interrompue en faveur d’un médicament ciblé dès que le laboratoire produira un rapport valide confirmant qu’un micro-organisme pathogène spécifique a été identifié.
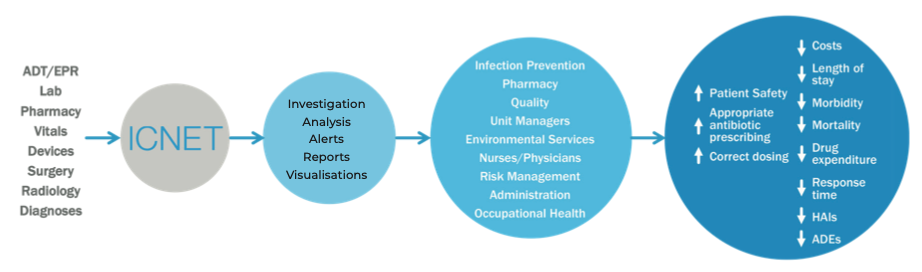
Fig. 4. Schéma de fonctionnement de la plate-forme de surveillance des infections ICNet
Une telle plateforme peut apporter de grands avantages au sein d’un établissement de santé, tels que la réduction des infections du site chirurgical (ISM)18, la réduction de la charge de travail de l’équipe de surveillance des infections 19 et la réduction significative de la prescription d’antibiotiques à large spectre 20 et de l’utilisation d’antibiotiques en général21.
L’adoption d’une plateforme spécifique de surveillance des infections permet un meilleur contrôle de la prise en charge des patients et, par conséquent, favorise le déplacement éventuel de l’hôpital vers le territoire, par exemple pour traiter les patients chroniques et/ou pour la phase post-opératoire.
Dispositifs pour assainir des pièces à l’aide de la technologie d’éclairage
Bien que la fourniture de thérapies au domicile du patient offre tous les avantages décrits dans les paragraphes précédents, l’environnement domestique peut ne pas être en mesure de garantir des conditions de biosécurité adéquates. Pour cette raison, dans le cas de patients particulièrement délicats ou critiques, il pourrait être utile d’adopter un système permettant la désinfection continue des environnements.
Certaines technologies très prometteuses ont été développées sur la base du concept de désinfection continue à l’aide de fréquences de lumière visible, sans émission de rayonnement ionisant nulle, qui, tout en éclairant les pièces, les désinfectent en continu. Ces technologies sont conçues pour assurer la désinfection sans stériliser l’environnement et contrôler la prolifération des bactéries et des virus agissant en synergie avec la résilience naturelle du système immunitaire humain.
Cette technologie repose sur les prémisses suivantes 22 :
- Évitez la « recontamination ». La « recontamination » est le rétablissement d’une population microbienne potentiellement pathogène dans des environnements qui ont été précédemment traités avec des désinfectants chimiques ; comme vous pouvez facilement l’imaginer, une fois qu’une surface ou un environnement a été traité par des systèmes d’assainissement physiques ou chimiques, il est inévitable qu’il soit à nouveau contaminé dès que des êtres vivants commencent à le visiter.
- Lutter contre le phénomène de « resistome » (le resistome est le matériel génétique échangé entre les micro-organismes qui permet l’acquisition d’informations génétiques favorisant la résistance aux antibiotiques). L’utilisation inconsidérée de désinfectants et d’antibiotiques favorise la fixation dans différentes populations de micro-organismes et de mutations qui les protègent au détriment des populations sensibles. De cette façon, ils occupent des espaces de vie de plus en plus grands et deviennent fixes.
- Concept d’antagonisme compétitif. Il n’élimine pas tous les micro-organismes de manière incontrôlée, mais, bien qu’il élimine les germes pathogènes, il favorise l’établissement de colonies stables de « probiotiques ».
- La technologie est « personnalisable », elle peut être calibrée pour assurer l’efficacité requise par les environnements présentant différents niveaux de risque microbiologique.
Cette technologie s’est avérée efficace sur différents types de bactéries GRAM+ et GRAM-, virus (y compris le SRAS-Cov-2), champignons, spores et moisissures, dans les tests in vitro et in vivo 23.
Le simple remplacement des lumières par ce type d’appareil vous permettra d’augmenter le niveau de biosécurité des environnements, en réduisant les risques résiduels de contamination et en maximisant leur efficacité.
De plus, ces technologies peuvent être intégrées à des capteurs IoT alimentés sur le réseau Ethernet (PoE = Power over Ethernet) qui offrent les avantages suivants :
- Connexion basse tension, installation facile.
- Il intègre la technologie de lumière désinfectante décrite ci-dessus.
- Détection de la présence, de la température, de l’humidité, des COV (composés organiques volatils), de la lumière ambiante, du CO2.
- Intégrer des voyants lumineux pour prendre en charge de nombreux cas d’utilisation.
- Ils vous permettent d’identifier et de montrer le niveau d’occupation d’une pièce, de définir des cycles d’assainissement, de gérer des parcours cliniques et des alertes.
Orchestration des processus de soins de santé
Chaque fois qu’une voie clinique est transférée de l’hôpital vers le territoire, il est nécessaire d’adopter des outils garantissant sa gouvernance, c’est-à-dire des outils permettant une exécution efficace et en temps opportun, et la synchronisation des activités entre tous les opérateurs impliqués, augmentant ainsi l’efficacité associée.
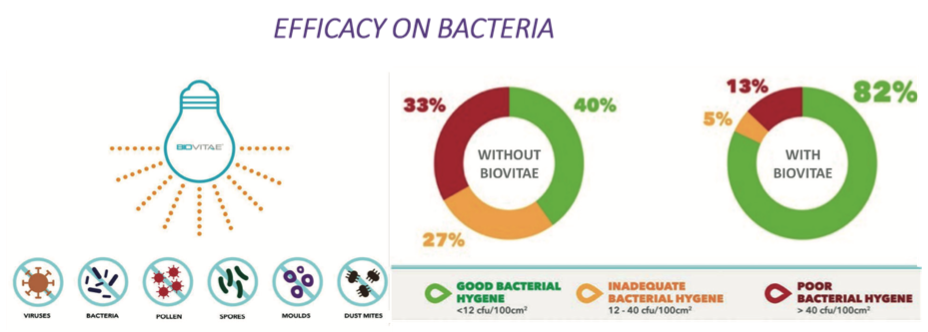
Fig. 5. Résultats de l’application de Biovitae Lights sur les bactéries.
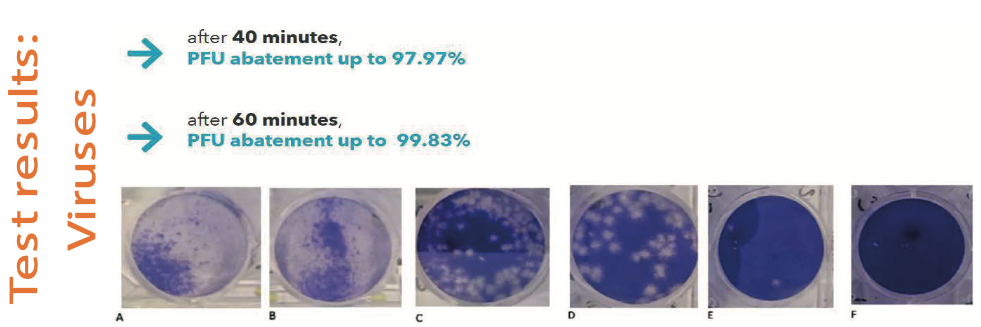
Fig. 6. Résultats de l’application Bioviae Lights sur les virus.
Ce niveau de synchronisation – ou « orchestration » – est réalisable grâce à l’utilisation de couches technologiques déjà disponibles aujourd’hui :
- Un référentiel commun où agréger toutes les données cliniques collectées.
- Un schéma sémantique commun garantissant la maintenance des données lors des interactions entre tous les opérateurs et systèmes impliqués.
- Un moyen par lequel les différents systèmes d’information peuvent partager non seulement des données et des informations, mais aussi des éléments contextuels tels que des événements et des métadonnées (c’est-à-dire des données relatives à des données fournissant une description du contexte).
- La description des interactions entre tous les opérateurs impliqués à travers une notation standard permettant une description correcte et précise du processus, de sa mise en œuvre et de sa synchronisation.
|||UNTRANSLATED_CONTENT_START|||Through this approach24|||UNTRANSLATED_CONTENT_END|||, il sera possible de mettre en œuvre un outil centralisé et intégré à travers lequel la prise en charge des patients à domicile : une fois qu’un patient aura été encadré dans l’une des voies de soins à domicile possibles, il suffira de créer une nouvelle instance de la voie orchestrée appropriée et tous les systèmes et opérateurs impliqués seront informés rapidement et en temps opportun de ce que l’on attend d’eux.
En outre, il sera possible d’analyser les performances du processus en temps réel : il sera possible de repérer les goulets d’étranglement, de mesurer le temps d’exécution de chaque voie et de mesurer en permanence des indicateurs de performance clés (KPI) spécifiques pour s’assurer que le service fourni correspond aux exigences.
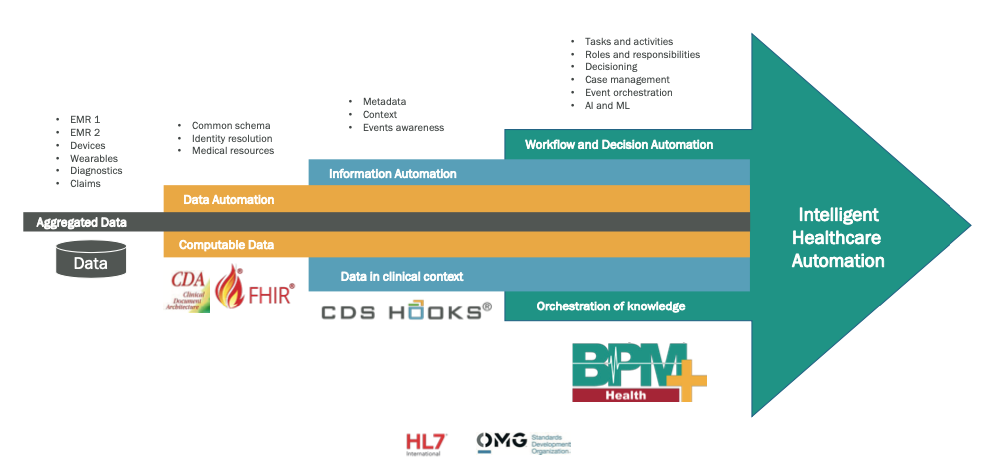
Fig. 7. Couches numériques composant un système intelligent d’automatisation des soins de santé.
Conclusions
Les maladies infectieuses peuvent être contrôlées et, espérons-le, prévenues grâce à la mise en œuvre de programmes mondiaux de surveillance et d’éducation dans les établissements de santé et à la sensibilisation de la population en général.
en outre, un investissement, un développement et une adoption clairs des technologies numériques à l’échelle mondiale peuvent soutenir le système de santé mondial et les prestataires de soins de santé pour réduire/gérer les IAS et, tout en augmentant/garantissant les grammes aux patients bien éduqués/illuminateurs déjà disponibles aujourd’hui : prévenir/contrôler les infections, l’accès aux soins à domicile, les patients proggés.
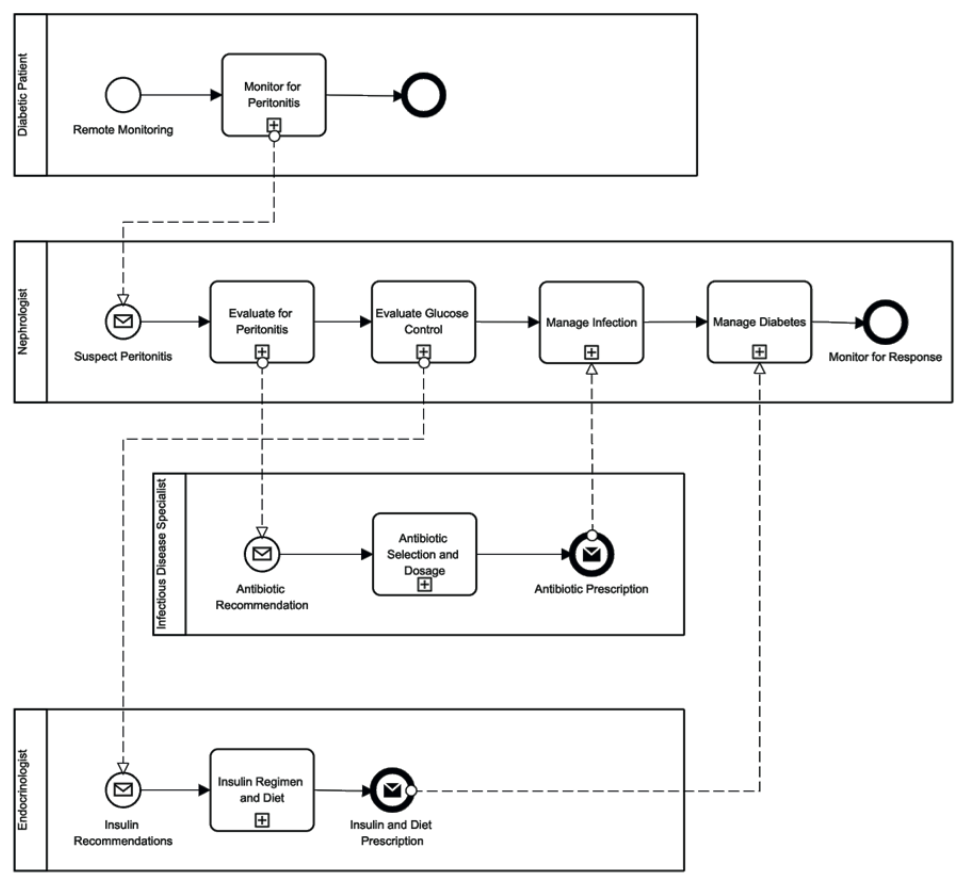
Fig. 8. Le modèle BPMN de la voie de la santé se concentre sur les patients diabétiques inscrits dans un programme APD.