Inleiding: de rol van zorginfecties
De pandemische influenza (H1N1) in 2009, de ebolavirusdreiging in West-Afrika in 2014 en Covid-19 in 2020 laten zien dat internationale bedreigingen door nieuwe infecties op elk moment kunnen ontstaan. Met name de Covid-19-pandemie bracht een ongekende uitdaging voor de volksgezondheid met zich mee en benadrukte de noodzaak om te investeren in gezondheidsstelsels, om voorbereid te zijn op wereldwijde noodsituaties op het gebied van de gezondheid en deze mogelijk te voorkomen.
Infectieziekten zijn niet alleen de belangrijkste oorzaak van de wereldwijde crisis, maar ook de belangrijkste doodsoorzaak in de wereld, met name in landen met een laag inkomen en bij jonge kinderen.
In 2019 werden twee infectieziekten – lagere luchtweginfecties en diarree – door de Wereldgezondheidsorganisatie (WHO)1 wereldwijd in de top tien van doodsoorzaken gerangschikt.
Parallel aan door de gemeenschap opgelopen infecties komen de afgelopen jaren zorginfecties (HAI ‘s) op. HAI ’s zijn infecties die patiënten oplopen tijdens het ontvangen van gezondheidszorg”2.
Sinds vele jaren wordt de verspreiding van infecties nauwlettend gevolgd door specifieke nationale en internationale instanties, zoals het Centrum voor ziektepreventie en -bestrijding (CDC) in Amerika en in Europa (ECDC), die tot taak hebben de huidige en opkomende bedreigingen voor de menselijke gezondheid als gevolg van infectieziekten te identificeren, te beoordelen en te communiceren.
Dankzij deze surveillancesystemen zijn de meest frequent gerapporteerde zorginfecties in Europa bekend en worden hieronder3 gerapporteerd:
Luchtweginfecties (21,4% pneumonie en 4,3% andere lagere luchtweginfecties).
- Urineweginfecties (18,9%).
- Infecties op de operatieplaats (18,4%).
- Infecties van de bloedbaan (10,8%).
- Gastro-intestinale infecties (8,9%),
clostridium difficile-infectie vertegenwoordigde 44,6% van de laatste (4,9% van alle zorginfecties).
In de afgelopen decennia hebben veel ziekenhuizen surveillance- en trackingprogramma ’s opgezet, samen met robuuste preventiestrategieën, om het percentage zorginfecties te verminderen. Nosocomiale infecties houden vaak verband met antibioticaresistente infecties en hebben daarom niet alleen gevolgen voor individuen, voor één patiënt, maar ook voor de lokale gemeenschappen waartoe deze persoon behoort.
Antimicrobiële resistentie (AMR) verwijst naar het vermogen van micro-organismen om antimicrobiële behandelingen te weerstaan 4). Het overmatig gebruik, het misbruik en de zelftoediening van antibiotica (met name in Italië, dat samen met Griekenland de eerste plaats inneemt voor sterfgevallen als gevolg van antibioticaresistentie5) houden verband met de verspreiding van micro-organismen die er resistent tegen zijn, waardoor de behandeling ineffectief wordt en een ernstig risico voor de volksgezondheid vormt.
Ondanks veel alarmsignalen van de WHO en meerdere internationale campagnes die wereldwijd zijn opgezet, is het aantal sterfgevallen als gevolg van antibioticaresistentie toegenomen en zal dit aantal elk jaar stijgen tot 10 miljoen per sterfgeval in 20506.
Het probleem is dat bacteriën niet alleen resistent worden tegen antibiotica, maar ook in staat zijn om de resistentie over te dragen aan toekomstige bacteriële populaties. Dit betekent dat de populatie van resistente bacteriën zo snel groeit dat resistente ziekteverwekkers zich snel zullen uitbreiden naar mensgebonden omgevingen (zoals luchthavens, openbaar vervoer, scholen, werkplekken, sportscholen, etc…).
Voor infecties veroorzaakt door bacteriën lijkt het duidelijk dat de oplossing niet kan worden gezocht door het gebruik van nieuwe antibiotica te verhogen, maar door het ontwikkelen van een alomvattend plan en richtlijnen voor de preventie van zorginfecties, effectievere en tijdiger diagnosesystemen, zowel in zorginstellingen als thuis.
Thuiszorg is een mogelijke hulpbron?
Het verplaatsen van patiënten van ziekenhuiszorg naar thuiszorg zou een reeks positieve effecten hebben, zoals een lagere verspreiding van infectieziekten in het milieu, een vermindering van het risico op het oplopen van infecties door patiënten die al verzwakt zijn door chronische ziekten, een grotere beschikbaarheid van klinische faciliteiten voor patiënten die vooral in het ziekenhuis moeten worden opgenomen en, ten slotte, een verlaging van de kosten voor de gezondheidszorgstelsels.7.
Reeds begin 2000 werden verschillende patiëntenbewakingsinitiatieven op afstand gepubliceerd ter ondersteuning van het vermogen om patiënten thuis te behandelen met als doel de effectiviteit van de behandeling en de bijbehorende uitkomst te verbeteren 8. In de daaropvolgende jaren is begonnen met de integratie van niet-homogene klinische informatie in de werkstromen in de gezondheidszorg door de toenemende toepassing van normen voor gegevens- en procesinteroperabiliteit9, wat heeft geleid tot het huidige scenario waarin, zoals in het volgende hoofdstuk wordt beschreven, moderne digitale gezondheidstechnologieën een zinvolle impuls kunnen geven aan de thuiszorg.
Deze sectie beschrijft drie thuiszorgscenario ’s waar digitale technologieën vandaag al beschikbaar zijn en geïntegreerd zijn in het beheer van chronische patiënten. Thuiszorgprogramma ’s kunnen samen met digitale tools zorgprofessionals ondersteunen om de kritieke aspecten te overwinnen die kunnen ontstaan bij het verplaatsen van chronische patiënten van het ziekenhuis naar het grondgebied, en dat kan de thuiszorgtoepassing beperken (of zelfs uitsluiten).
Onze ervaring is vooral gericht op thuis parenterale voeding (HPN), peritoneale dialyse (PD) en poliklinische parenterale antibioticatherapie (OPAT), maar er zijn veel andere therapeutische gebieden waar thuiszorg vandaag van toepassing is en nog meer binnenkort.
Parenterale voeding thuis
Parenterale voeding (PN) is een levensreddende therapie die wordt gegeven door intraveneuze toediening (IV) van voedingsstoffen (zoals aminozuren, glucose, lipiden, elektrolyten, vitaminen en sporenelementen), buiten het maagdarmkanaal. Totale parenterale voeding (TPN) is wanneer de IV toegediende voeding de enige bron van voeding is die de patiënt ontvangt.
De belangrijkste bijwerkingen geassocieerd met PN kunnen te wijten zijn aan metabole afwijkingen, infectierisico, of veneuze toegang geassocieerd10.
De overgang van ziekenhuis- naar territoriaal gebaseerde parenterale voeding kan de blootstelling van de patiënt aan nosocomiale infecties beperken/voorkomen, maar kan ook significante risico ’s en extra kwetsbaarheden van de patiënt opleveren als deze niet systematisch worden gemonitord en aangepakt.
Als gevolg hiervan kunnen de behandelingsvoordelen van HPN worden gehinderd door complicaties en bijwerkingen die anders vermijdbaar zijn 11.
De wijze waarop zorgorganisaties continuïteit van zorg implementeren, heeft een sterke impact op de veiligheid van HPN-programma ‘s.
De risico ’s voor de veiligheid van de patiënt op het moment van ontslag kunnen hoog zijn en kunnen leiden tot een hoge mate van terugkeer naar het ziekenhuis12. Deze problemen kunnen echter worden voorkomen door adequate strategieën en duidelijke protocollen vast te stellen13. Vaak zijn de cruciale kwesties die bepalend zijn voor de overname van de patiënt en die het risico voor zijn/haar veiligheid verhogen, directe gevolgen van een gebrek aan coördinatie tussen territoriale en ziekenhuissystemen. Deze kriticiteiten veroorzaken onderbrekingen in de informatiestroom, het beheer en de coördinatie14.
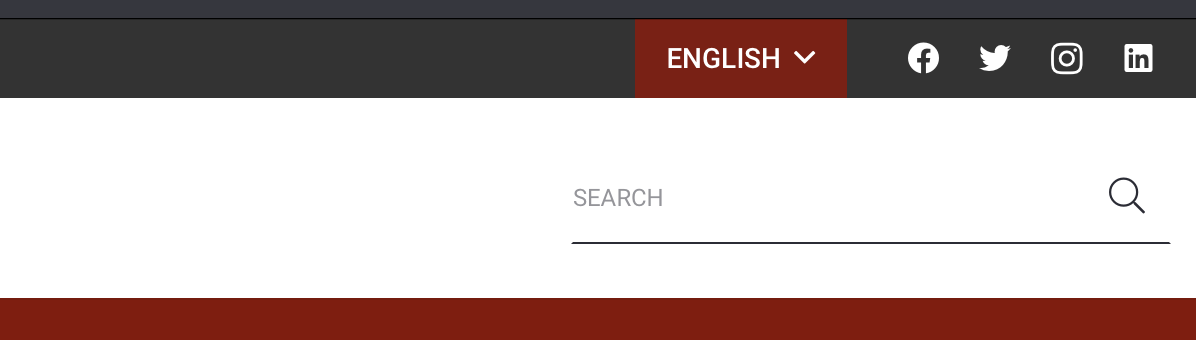
Moderne digitale technologieën (Figuur 1) maken de implementatie van geautomatiseerde processen mogelijk door de invoering van webplatforms voor de coördinatie van activiteiten die bij de patiënt thuis worden geleverd (bijvoorbeeld verpleegkundige hulp, grondstoffen, het delen van klinische gegevens) en het beheer van onverwachte situaties met de mogelijke betrokkenheid van ziekenhuisartsen en/of extern personeel.
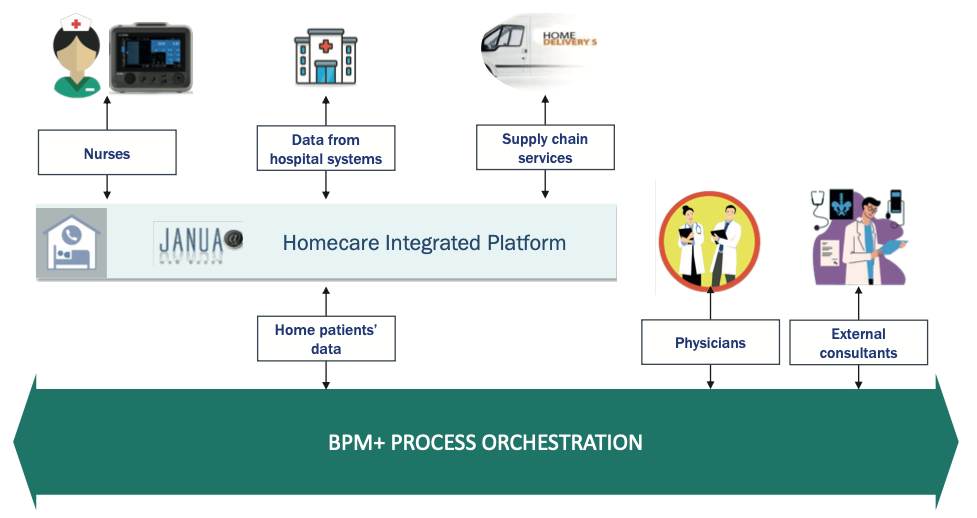
Fig. 1. Digitale Technologieën ondersteunen Parenterale Voeding Thuiszorg programma.
Een efficiënte en effectieve HPN-dienstverlening kan alleen worden geleverd door het implementeren van een constante en tijdige coördinatie van alle activiteiten, variërend van de overname van de patiënt tot de inkoop van grondstoffen en het bijbehorende administratieve beheer van het hele proces.
De vaststelling van een webplatform ter ondersteuning van dit proces maakt het mogelijk om:
- Beheer het zorgcontinuüm in realtime.
- Informatie delen in de transitie van ziekenhuis naar huis en vice versa.
- Zorg voor een geïntegreerd en ideaal patiëntenbeheer.
- Toezicht houden op de uitvoering van de geleverde dienst.
peritoneale dialyse
In aanvulling op de voordelen die al uit de thuiszorg voortvloeien, is de mogelijkheid om patiënten met chronische nierziekte die thuis niervervangende therapieën ondergaan met peritoneale dialyse (PD) te behandelen een kostbare hulpbron die patiënten in staat stelt een quasi-normaal leven te leiden.
De snel evoluerende digitale technologie opent nu de deuren naar tal van mogelijkheden, zoals patiëntbewaking op afstand (RPM), terwijl het uitvoeren van PD thuis met de nieuwste generaties van PD-fietsers (Automated Peritoneal Dialysis – APD)15.
Tijdens APD, RPM met draadloze sensoren maken een constante patiënt biometrische data-acquisitie van de cycler voor de gehele duur van de behandeling (Figuur 2). Medewerkers van de gezondheidszorg (toegewijde artsen en PD-verpleegkundigen) kunnen worden toegewezen en geautoriseerd om toegang te krijgen tot deze gegevens via pc/tablets/telefoons om de patiëntbehandelingen te monitoren op elk moment, van overal.

Fig. 2. APD-systeemarchitectuur.
De nieuwe generatie fietsers die vandaag aan de patiënt thuis zijn toegewezen, kunnen autonoom communiceren met het ziekenhuis (waar het operationele klinische centrum zich bevindt) en het verzamelen van patiëntgegevens aan het einde van elke afzonderlijke APD-behandeling toestaan.
Gegevens verzameld van patiënten, zowel biometrische als APD-behandelgerelateerde, worden voortdurend door het systeem geanalyseerd en kunnen worden omgezet in alarmen/waarschuwingen voor de zorgverleners die verantwoordelijk zijn voor het beheer van de patiënt.
Artsen en verpleegkundigen kunnen op afstand patiëntgegevens controleren en besluiten om het PD-schema/ recept op afstand te wijzigen, indien nodig.
De impact van het op afstand aanpassen van behandelingen/medische voorschriften kan de naleving van de patiënt verbeteren, de resultaten van patiënten optimaliseren en de veiligheid van patiënten verbeteren.
Bovendien kan het vermijden van meervoudige toegang van de patiënten tot hun referentieziekenhuis voor het beoordelen/wijzigen van de behandelingen de last verminderen die wordt gevoeld door gezinnen die thuis zorg verlenen, de therapietrouw verbeteren en door middel van real-time feedbacklussen om kennis te verbeteren door middel van geïndividualiseerd onderwijs.
Parenterale antibioticatherapie, poliklinische
Het concept van Poliklinische Parenterale Antibiotica Therapie (OPAT), geboren in de vroege jaren 1980 in de Verenigde Staten met als doel het samenbrengen van een kostenreductie en een verbetering van de kwaliteit van leven van de patiënt als gevolg van een korter verblijf in het ziekenhuis, en van een meer gastvrije en comfortabele omgeving rondom de patiënt16.
Om de OPAT echter onafhankelijk door de patiënt uit te voeren, moeten de volgende stappen worden gegarandeerd:
- Juistheid van de dosering van het geneesmiddel en de componenten ervan.
- Afwezigheid van milieuverontreiniging.
- Juiste toedieningssnelheid.
Tegenwoordig is het mogelijk om de OPAT te beheren via een thuisgebaseerd proces (figuur 3) en de invoering van moderne biomedische technologieën.
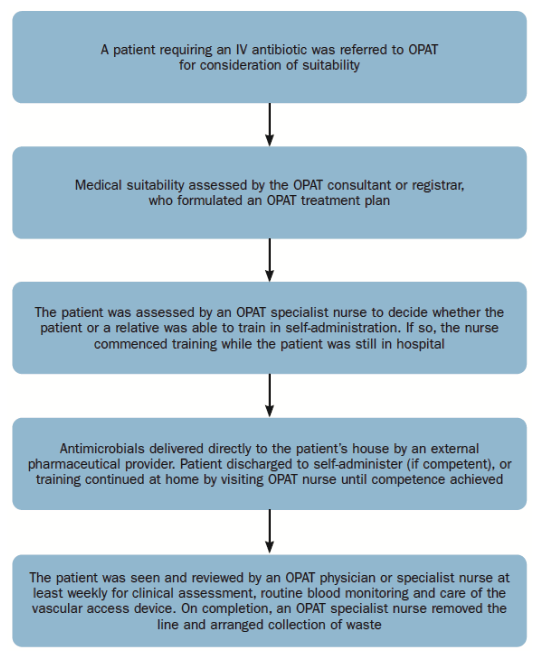
Fig. 3. OPAT-home-based proces
Met het gebruik van deze innovatieve technologieën kunnen patiënten/ verzorgers die niet in staat zijn om de antimicrobiële stoffen op de traditionele manier te mengen, worden getraind in het gebruik van aseptisch gevulde elastomeerapparaten die vooraf worden gemengd door externe farmaceutische leveranciers.
Met behulp van 24-uurs continue infusieapparaten kunnen bèta-lactamantibiotica zoals flucloxacilline, benzylpenicilline en piperacilline met tazobactam door de patiënten zelf worden toegediend, waarbij het ziekenhuis voor de duur van de behandeling wordt vermeden.
Oudere patiënten of patiënten met behendigheidsproblemen, patiënten op complexe en multi-drugsregimes en patiënten voor wie continue bèta-lactamantibiotica de voorkeursbehandeling waren, kunnen nu worden gedehospitaliseerd door hen te voorzien van een elastomeerapparaat, dat een elastomeer “ballon” bevat: aangezien dit na verloop van tijd leegloopt, duwt het de antimicrobiële stof voorzichtig door de intraveneuze infusieset die het geneesmiddel van het apparaat naar de katheter/poort voert, waardoor een betrouwbare en nauwkeurige stroomsnelheid wordt verkregen.
Huidige en toekomstige digitale gezondheidstechnologieën voor infectiebeheer
Moderne digitale technologieën zijn waardevolle middelen om de verspreiding van infecties aan te pakken en de overgang van het ziekenhuis naar het huis van de patiënt te ondersteunen.
De implementatie van digitale apparaten, zowel in ziekenhuizen als thuis, kan:
- Faciliteer vroegtijdige identificatie van infectierisico ’s en laat snelle interventie door medisch en verpleegkundig personeel toe.
- Zorgen voor een voorzichtiger beheer van breedspectrumantibiotica, doeltreffender voorkomen van antibioticaresistentie en verbeteren van het type en de dosering van de juiste antimicrobiële therapie.
- Maximaliseer de bioveiligheid van het milieu.
- Garandeer het beheer van de therapeutische diensten die aan het gebied worden geleverd, dankzij realtime prestatiemonitoring.
Enkele voorbeelden van deze technologieën worden in de onderstaande paragrafen beschreven.
Webplatform voor infectiebewaking
Tot enkele jaren geleden werden activiteiten op het gebied van infectiebewaking uitgevoerd door interdisciplinaire medische teams die gegevens uit verschillende ziekenhuisinformatiesystemen, zoals het elektronisch medisch dossier en/of het laboratoriuminformatiesysteem (LIS), analyseren.
De noodsituatie op het gebied van de gezondheidszorg in verband met ziekenhuisinfecties die worden veroorzaakt door antibioticaresistentie zet de aandacht op gezondheidstoezichtteams, die de behoefte aan een geautomatiseerde en frequentere extractie van een groeiend aantal niet-homogene klinische gegevens hebben vergroot.
Aanbieders van medische informatiesystemen lopen achter op innovatie op het gebied van infectiebewaking, wat ertoe heeft geleid dat veel zorgorganisaties zich hebben uitgerust met specifieke instrumenten voor bewaking en geavanceerde infectiebestrijding17.
Een specifiek platform voor infectiebewaking moet op transparante wijze gegevens kunnen verzamelen van elk bestaand informatiesysteem binnen een zorgorganisatie: register voor opname, ontslag en patiëntenoverdracht, microbiologisch laboratorium, operatiekamers, medische apparatuur, radiologie, enz.
De verzamelde gegevens worden verwerkt door algoritmen die potentiële risico ’s onmiddellijk kunnen detecteren, zoals:
- De aanwezigheid, in een specifiek tijdsbestek, van twee of meer gevallen van een besmettelijk micro-organisme gedetecteerd op patiënten die in dezelfde afdeling zijn opgenomen.
- De overname van een patiënt die het afgelopen jaar een ernstige infectie heeft gehad.
Wanneer zich een potentieel risico op infecties voordoet, wordt het surveillancepersoneel daarvan onmiddellijk in kennis gesteld, zodat passende voorzorgsmaatregelen kunnen worden genomen om het ontstaan van epidemische clusters te voorkomen.
Bovendien kunnen deze systemen ook een geldige ondersteuning bieden in het antimicrobiële rentmeesterschap. Als voorbeeld kan het voorschrijven van een breedspectrumantibioticum onmiddellijk worden onderbroken ten gunste van een gericht geneesmiddel zodra het laboratorium een geldig rapport genereert waarin wordt bevestigd dat een specifiek pathogeen micro-organisme is geïdentificeerd.
Fig. 4. ICNet platform voor infectiebewaking functioneringsschema
Een dergelijk platform kan grote voordelen opleveren binnen een zorginstelling, zoals het verminderen van Chirurgische Infecties (SSI)18, het verminderen van de werklast van het team voor infectiebewaking 19, en het aanzienlijk verminderen van het breed-spectrum antibiotica recept20 en het gebruik van antibiotica in het algemeen21.
De invoering van een specifiek platform voor de bewaking van infecties maakt een betere beheersing van de behandeling van patiënten mogelijk en bevordert bijgevolg de mogelijke verplaatsing van het ziekenhuis naar het grondgebied, bijvoorbeeld voor de behandeling van chronische patiënten en/of voor de postoperatieve fase.
Apparaten voor het ontsmetten van ruimtes met behulp van verlichtingstechnologie
Hoewel het verstrekken van therapieën bij de patiënt thuis alle voordelen biedt die in de vorige paragrafen worden beschreven, is het mogelijk dat de thuisomgeving niet in staat is om adequate biobeveiligingsomstandigheden te garanderen. In het geval van bijzonder kwetsbare of kritieke patiënten zou het daarom nuttig kunnen zijn een systeem in te voeren dat de voortdurende ontsmetting van omgevingen mogelijk maakt.
Een aantal veelbelovende technologieën zijn ontwikkeld op basis van het concept van continue ontsmetting met behulp van frequenties van zichtbaar licht, zonder nul ioniserende straling, die, terwijl het verlichten van de kamers, voortdurend ontsmetten ze. Deze technologieën zijn ontworpen om ontsmetting te bieden zonder sterilisatie van het milieu en controle van de proliferatie van bacteriën en virussen in synergie met de natuurlijke veerkracht van het menselijk immuunsysteem.
Deze technologie is gebaseerd op de volgende uitgangspunten22:
- Vermijd “herbesmetting”. “Herbesmetting” is het herstel van een potentieel pathogene microbiële populatie in omgevingen die eerder zijn behandeld met chemische ontsmettingsmiddelen; zoals je je gemakkelijk kunt voorstellen, zodra een oppervlak of een omgeving is behandeld door middel van fysische of chemische ontsmettingssystemen, is het onvermijdelijk dat het zal worden herbesmet zodra levende wezens beginnen te bezoeken.
- Het tegengaan van het fenomeen ‘resistome’ (het resistome is het genetisch materiaal dat tussen micro-organismen wordt uitgewisseld en dat de verwerving van genetische informatie ten gunste van resistentie tegen antibiotica mogelijk maakt). Het roekeloze gebruik van ontsmettingsmiddelen en antibiotica bevordert de fixatie in verschillende populaties van micro-organismen en mutaties die hen beschermen ten koste van gevoelige. Op deze manier bezetten ze steeds grotere woonruimtes en worden ze gefixeerd.
- Concept van competitief antagonisme. Het elimineert niet alle micro-organismen op een ongecontroleerde manier, maar hoewel het pathogene kiemen elimineert, bevordert het de vestiging van stabiele kolonies van “probiotica.
- De technologie is “aanpasbaar”, kan het worden gekalibreerd om de doeltreffendheid te verzekeren die door milieu ’s met verschillende niveaus van microbiologische risico’ s wordt vereist.
Deze technologie bleek werkzaam te zijn op verschillende soorten GRAM+ en GRAM-BACTERIËN, virussen (waaronder SARS-Cov-2), schimmels, sporen en schimmels, zowel in vitro als in vivo 23.
Het eenvoudig vervangen van de lichten door dit type apparaat zal u toelaten om het niveau van bioveiligheid van de omgevingen te verhogen, het verminderen van eventuele resterende risico ’s van besmetting en het maximaliseren van hun effectiviteit.
Bovendien kunnen deze technologieën worden geïntegreerd met IoT-sensoren die worden gevoed via het Ethernet-netwerk (PoE = Power over Ethernet), die de volgende voordelen bieden:
- Laagspanningsaansluiting, eenvoudige installatie.
- Het integreert de hierboven beschreven ontsmettingslichttechnologie.
- Detectie van aanwezigheid, temperatuur, vochtigheid, VOS (vluchtige organische verbinding), omgevingslicht, CO2.
- Integreer indicatielampjes om veel gevallen van gebruik te ondersteunen.
- Ze stellen u in staat om het niveau van bezetting van een kamer te identificeren en te tonen, sanitaire cycli te definiëren, klinische paden en waarschuwingen te beheren.
Orkestratie van het zorgproces
Wanneer een klinisch traject van het ziekenhuis naar het grondgebied wordt overgebracht, is het noodzakelijk om instrumenten aan te nemen die de governance ervan garanderen, d.w.z. instrumenten die een effectieve en tijdige uitvoering mogelijk maken en de activiteiten synchroniseren tussen alle betrokken exploitanten, waardoor de daarmee samenhangende efficiëntie wordt verhoogd.
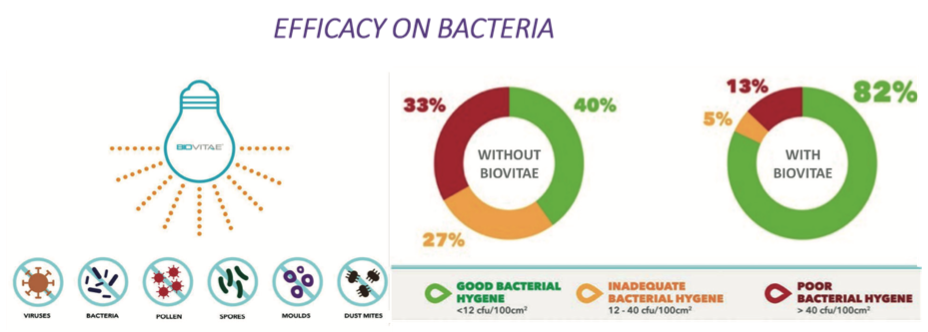
Fig. 5. Resultaten van Biovitae licht toepassing op bacteriën.
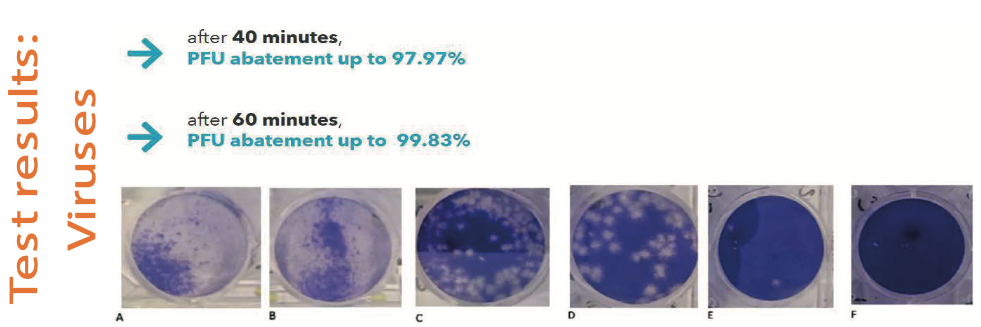
Fig. 6. Resultaten van Bioviae licht toepassing op virussen.
Dit niveau van synchronisatie – of “orkestratie” – is mogelijk dankzij het gebruik van technologische lagen die vandaag al beschikbaar zijn:
- Een gemeenschappelijk depot waar alle verzamelde klinische gegevens kunnen worden samengevoegd.
- Een gemeenschappelijke semantische regeling die gegevens garandeert die onderhoud tijdens interacties tussen alle betrokken exploitanten en systemen inhouden.
- Een middel waarmee de verschillende informatiesystemen niet alleen gegevens en informatie kunnen delen, maar ook contextuele elementen zoals gebeurtenissen en metagegevens (d.w.z. gegevens met betrekking tot gegevens die een contextbeschrijving geven).
- De beschrijving van de interacties tussen alle betrokken operators door middel van een standaardnotatie die een correcte en nauwkeurige beschrijving van het proces en de implementatie en synchronisatie ervan mogelijk maakt.
Door deze aanpak24, zal het mogelijk zijn om een gecentraliseerd en geïntegreerd instrument te implementeren waarmee de zorg voor thuispatiënten wordt verzorgd: zodra een patiënt is ingelijst in een van de mogelijke thuiszorgroutes, zal het voldoende zijn om een nieuw exemplaar van het juiste georkestreerde pad te creëren en zullen alle betrokken systemen en operators snel en tijdig worden geïnformeerd over wat van hen wordt verwacht.
Daarnaast is het mogelijk om de procesprestaties in realtime te analyseren: het zal mogelijk zijn om eventuele knelpunten op te sporen, de uitvoeringstijd van elk traject te meten en voortdurend specifieke Kritische Prestatie Indicatoren (KPI ‘s) te meten om te controleren of de geleverde dienst in lijn is met de vereisten.
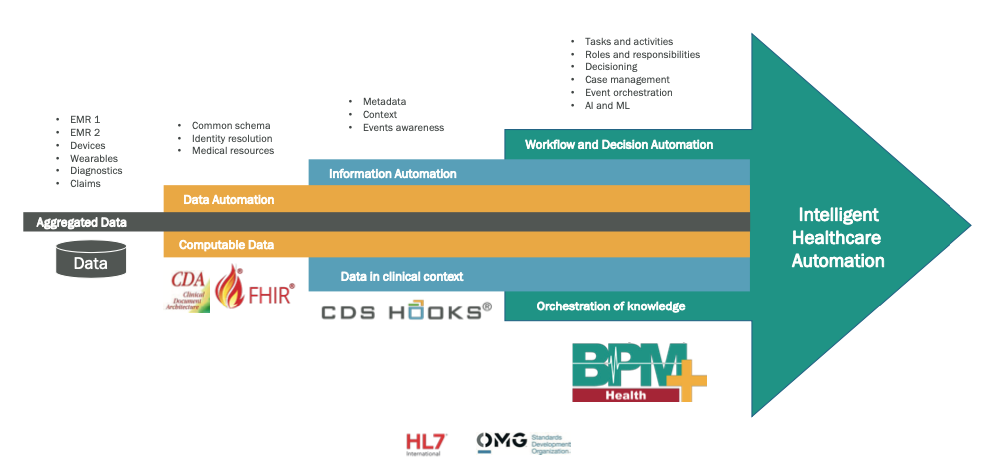
Fig. 7. Digitale lagen die een intelligent automatiseringssysteem voor de gezondheidszorg vormen.
Conclusies
Infectieziekten kunnen worden bestreden en hopelijk voorkomen door de implementatie van wereldwijde surveillance- en educatieve programma ’s in zorginstellingen en het creëren van bewustwording bij de algemene bevolking.
daarnaast kunnen duidelijke wereldwijde investeringen, ontwikkeling en invoering van digitale technologieën de wereldwijde gezondheidszorg en zorgaanbieders ondersteunen bij het verminderen/beheren van zorginfecties en bij het verhogen/verzekeren van grammen voor goed opgeleide/aanvragers die vandaag al beschikbaar zijn: infecties voorkomen/beheersen van toegang tot de thuiszorgpatiënten.
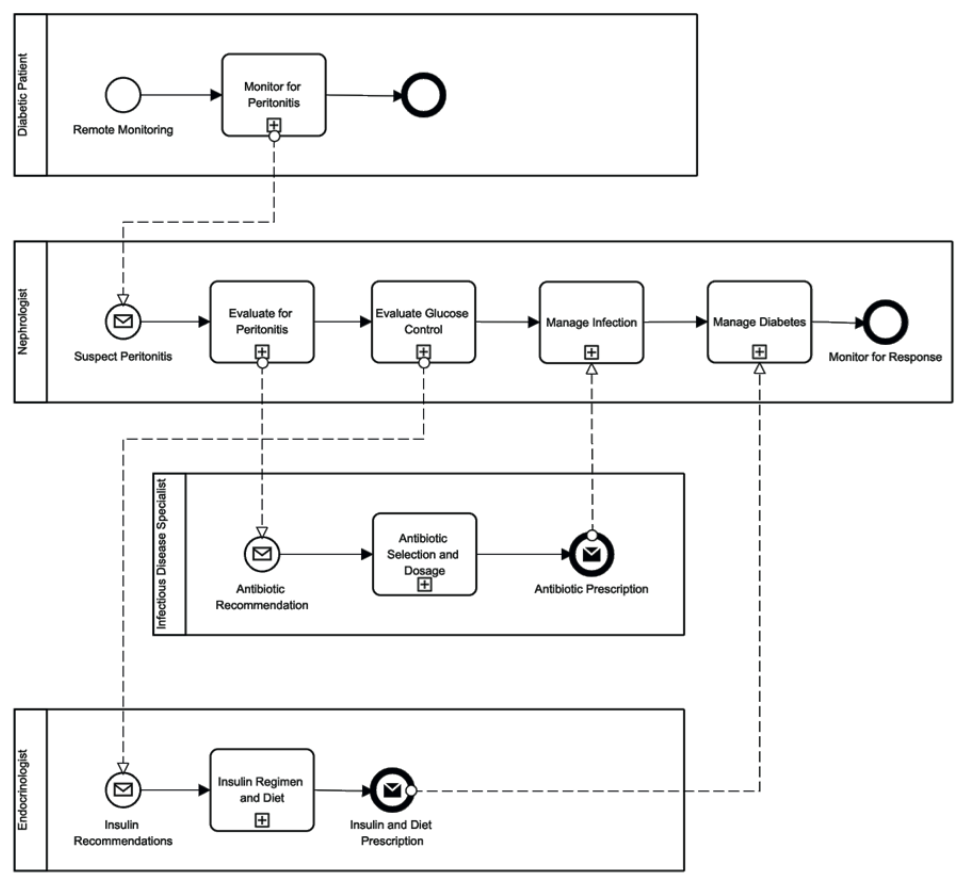
Fig. 8. BPMN-model van gezondheidszorgtraject gericht op diabetespatiënten die deelnemen aan een APD-programma.