Introduzione: il ruolo delle infezioni associate all’assistenza sanitaria
L’influenza pandemica (H1N1) nel 2009, la minaccia del virus Ebola in Africa occidentale nel 2014 e il Covid-19 nel 2020 mostrano che le minacce internazionali attraverso nuove infezioni possono emergere in qualsiasi momento. In particolare, la pandemia da Covid-19 ha portato una sfida senza precedenti alla salute pubblica, ha evidenziato la necessità di investire nei sistemi sanitari, di essere preparati a gestire le emergenze sanitarie globali e, possibilmente, di prevenirle.
Le malattie infettive non solo rappresentano la causa principale della crisi globale, ma sono ancora la principale causa di morte a livello mondiale, soprattutto nei paesi a basso reddito e nei bambini in tenera età.
Nel 2019, due malattie infettive – infezioni del tratto respiratorio inferiore e malattie diarroiche – sono state classificate tra le prime dieci cause di morte in tutto il mondo dall’Organizzazione Mondiale della Sanità (OMS)1.
Parallelamente alle infezioni acquisite in comunità, negli ultimi anni stanno emergendo infezioni associate all’assistenza sanitaria (HAI). Gli HAI sono quelle infezioni che i pazienti acquisiscono mentre ricevono assistenza sanitaria”2.
Da molti anni la diffusione delle infezioni è seguita da vicino da specifiche agenzie nazionali e internazionali come il Centre for Disease Prevention and Control (CDC) in America e in Europa (ECDC), con la missione di individuare, valutare e comunicare le minacce attuali ed emergenti alla salute umana poste dalle malattie infettive.
Grazie a questi sistemi di sorveglianza, gli HAI più frequenti segnalati in Europa sono ben noti e riportati di seguito3:
Infezioni delle vie respiratorie (21,4% polmonite e 4,3% altre infezioni del tratto respiratorio inferiore).
- Infezioni delle vie urinarie (18,9%).
- Infezioni del sito chirurgico (18,4%).
- Infezioni del flusso sanguigno (10,8%).
- Infezioni gastrointestinali (8,9%),
con infezione da Clostridium difficile che rappresenta il 44,6% di quest’ ultimo (4,9% di tutti gli HAI).
Negli ultimi decenni, molti ospedali hanno messo in atto programmi di sorveglianza e monitoraggio, insieme a solide strategie di prevenzione, per ridurre il tasso di Hai. Le infezioni nosocomiali sono spesso legate a infezioni resistenti agli antibiotici e, per questo motivo, hanno un impatto non solo sugli individui, sul singolo paziente, ma anche sulle comunità locali a cui questo individuo appartiene.
La resistenza antimicrobica (AMR) si riferisce alla capacità dei microrganismi di resistere ai trattamenti antimicrobici 4). L’uso eccessivo, l’uso improprio e l’autosomministrazione di antibiotici (soprattutto in Italia che è al primo posto in Europa insieme alla Grecia per decessi dovuti a resistenza agli antibiotici 5) sono stati collegati alla diffusione di microrganismi che sono resistenti ad essi, rendendo inefficace il trattamento e rappresentando un grave rischio per la salute pubblica.
Nonostante i numerosi allarmi lanciati dall’OMS e le molteplici campagne internazionali avviate in tutto il mondo, il numero di decessi per resistenza agli antibiotici è cresciuto e crescerà ogni anno fino a raggiungere i 10 milioni di morti all’anno nel 20506.
Il problema è che i batteri non solo diventano resistenti agli antibiotici, ma sono anche in grado di trasferire la resistenza alle future popolazioni batteriche. Ciò significa che la popolazione di batteri resistenti sta crescendo così rapidamente che gli agenti patogeni resistenti si estenderanno rapidamente agli ambienti legati all’uomo (come aeroporti, trasporti pubblici, scuole, luoghi di lavoro, palestre, ecc…).
Per le infezioni causate da batteri appare evidente che la soluzione non può essere ricercata aumentando l’uso di nuovi antibiotici ma sviluppando un piano e delle linee guida esaustive per la prevenzione delle Hai, sistemi diagnostici più efficaci e tempestivi, sia nelle strutture sanitarie che a casa.
L’assistenza domiciliare è una possibile risorsa?
Spostare i pazienti dall’assistenza ospedaliera all’assistenza domiciliare avrebbe una serie di effetti positivi, come una minore diffusione di malattie infettive nell’ambiente, una riduzione del rischio di contrarre infezioni da parte di pazienti già indeboliti da malattie croniche, una maggiore disponibilità di strutture cliniche per i pazienti che necessitano soprattutto di essere ricoverati in ospedale e, infine, una riduzione dei costi per i sistemi sanitari7.
Già all’inizio del 2000, sono state pubblicate diverse iniziative di monitoraggio remoto dei pazienti per supportare la capacità di trattare i pazienti a casa con l’obiettivo di migliorare l’efficacia del trattamento e l’esito associato 8. Negli anni successivi, l’integrazione di informazioni cliniche non omogenee nei flussi di lavoro sanitari è iniziata attraverso la crescente adozione di standard di interoperabilità dei dati e dei processi 9, portando allo scenario attuale in cui, come descritto nel capitolo seguente, le moderne tecnologie sanitarie digitali potrebbero portare un sensibile impulso all’assistenza domiciliare.
Questa sezione descrive tre scenari di assistenza domiciliare in cui già oggi le tecnologie digitali sono integrate nella gestione dei pazienti cronici. I programmi di assistenza domiciliare insieme agli strumenti digitali possono supportare gli operatori sanitari a superare gli aspetti critici che potrebbero sorgere quando si spostano i pazienti cronici dall’ospedale al territorio e che potrebbero limitare (o addirittura precludere) l’applicazione dell’assistenza domiciliare.
La nostra esperienza si concentra principalmente sulla nutrizione parenterale domiciliare (HPN), sulla dialisi peritoneale (PD) e sulla terapia antibiotica parenterale ambulatoriale (OPAT), ma ci sono molte altre aree terapeutiche in cui l’assistenza domiciliare è applicabile oggi e ancora più presto.
Nutrizione parenterale
La nutrizione parenterale (PN) è una terapia salvavita fornita attraverso la somministrazione endovenosa (IV) di nutrienti (come aminoacidi, glucosio, lipidi, elettroliti, vitamine e oligoelementi), al di fuori del tratto gastrointestinale. La nutrizione parenterale totale (TPN) è quando la nutrizione somministrata per via endovenosa è l’unica fonte di nutrizione che il paziente sta ricevendo.
I principali effetti avversi associati alla PN possono essere dovuti ad anomalie metaboliche, al rischio di infezione o all’accesso venoso associato10.
Il passaggio dalla nutrizione parenterale ospedaliera a quella territoriale può limitare/prevenire l’esposizione del paziente alle infezioni nosocomiali ma può anche comportare rischi significativi e ulteriori vulnerabilità del paziente se queste non vengono sistematicamente monitorate e affrontate.
Di conseguenza, i benefici del trattamento con HPN possono essere ostacolati da complicazioni ed eventi avversi altrimenti evitabili11.
I modi in cui le organizzazioni sanitarie implementano la continuità dell’assistenza hanno un forte impatto sulla sicurezza dei programmi HPN.
I rischi per la sicurezza del paziente al momento della dimissione possono essere elevati e potrebbero portare a un elevato tasso di ritorno in ospedale12. Tuttavia, questi problemi possono essere prevenuti adottando strategie adeguate e protocolli chiari 13. Spesso, le criticità che determinano la riammissione del paziente aumentando il rischio per la sua incolumità sono conseguenze dirette di una mancanza di coordinamento tra sistemi territoriali e ospedalieri. Queste criticità causano interruzioni nel flusso di informazioni, nella gestione e nel coordinamento14.
Le moderne tecnologie digitali (Figura 1) consentono l’implementazione di processi automatizzati attraverso l’introduzione di piattaforme web per il coordinamento delle attività erogate a domicilio del paziente (ad esempio, assistenza infermieristica, materie prime, condivisione dei dati clinici) e la gestione di situazioni impreviste con l’eventuale coinvolgimento di clinici ospedalieri e/o personale esterno.
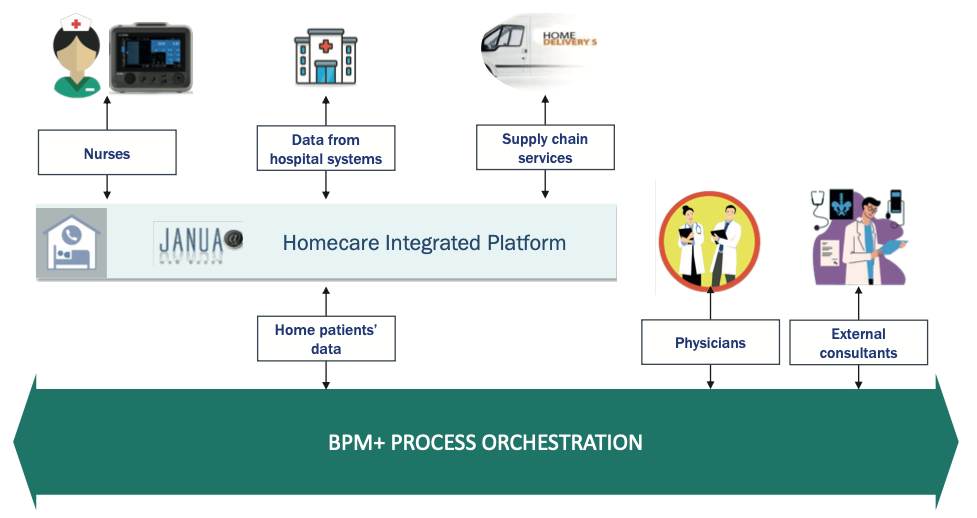
Fig. 1. Tecnologie digitali a supporto del programma di assistenza domiciliare per la nutrizione parenterale.
Un servizio HPN efficiente ed efficace può essere fornito solo attraverso un coordinamento costante e tempestivo di tutte le attività che vanno dalla presa in carico del paziente all’approvvigionamento delle materie prime e alla relativa gestione amministrativa dell’intero processo.
L’adozione di una piattaforma web pensata per supportare questo processo permette di:
- Gestisci il continuum di cura in tempo reale.
- Condividere le informazioni nel passaggio dall’ospedale alla casa e viceversa.
- Fornire una gestione del paziente integrata e ideale.
- Monitorare le prestazioni del servizio erogato.
Dialisi peritoneale
Oltre ai benefici già affrontati derivanti dall’assistenza domiciliare, la possibilità di gestire a domicilio pazienti con malattia renale cronica sottoposti a terapie sostitutive renali con dialisi peritoneale (PD) è una risorsa preziosa che consente ai pazienti di condurre una vita quasi normale.
La tecnologia digitale in rapida evoluzione ora apre le porte a numerose opportunità come il monitoraggio remoto del paziente (RPM) mentre esegue PD a casa con le ultime generazioni di ciclisti PD (dialisi peritoneale automatizzata – APD)15.
Durante l’APD, l’RPM con sensori wireless consente un’acquisizione costante dei dati biometrici del paziente dal ciclatore per tutta la durata del trattamento (Figura 2). Il personale sanitario (medici e infermieri PD dedicati) può essere assegnato e autorizzato ad accedere a questi dati attraverso pc/tablet/telefoni per monitorare il monitoraggio dei trattamenti dei pazienti in qualsiasi momento, da qualsiasi luogo.

Fig. 2. Architettura del sistema APD.
I ciclisti di nuova generazione oggi assegnati al paziente a domicilio, possono comunicare autonomamente con l’Ospedale (dove si trova il centro clinico operativo) e consentire la raccolta dei dati del paziente al termine di ogni singolo trattamento APD.
I dati raccolti dal paziente, sia biometrici che relativi al trattamento APD, sono costantemente analizzati dal Sistema e possono essere trasformati in allarmi/alert agli operatori sanitari responsabili della gestione del paziente.
Medici e infermieri possono controllare da remoto i dati del paziente e decidere di modificare il regime/la prescrizione di PD da remoto, se necessario.
L’impatto dell’adattamento di trattamenti/prescrizioni mediche da remoto può aumentare la compliance del paziente, ottimizzare gli esiti dei pazienti e migliorare la sicurezza dei pazienti.
Inoltre, evitando accessi multipli dei pazienti al loro ospedale di riferimento per la revisione/modifica dei trattamenti, ha il potenziale per ridurre l’onere avvertito dalle famiglie che forniscono assistenza a casa, per migliorare l’aderenza al trattamento e attraverso cicli di feedback in tempo reale per migliorare la conoscenza attraverso l’istruzione individualizzata.
Terapia antibiotica parenterale ambulatoriale
Il concetto di Terapia Antibiotica Parenterale Ambulatoriale (OPAT) nasce nei primi anni ’80 negli Stati Uniti con l’obiettivo di mettere insieme una riduzione dei costi e un miglioramento della qualità della vita del paziente derivante da una degenza ospedaliera più breve, e da un ambiente più accogliente e confortevole che circonda il paziente16.
Tuttavia, affinché l’OPAT sia eseguito in modo indipendente dal paziente, devono essere garantiti i seguenti passaggi:
- Correttezza del dosaggio del farmaco e dei suoi componenti.
- Assenza di contaminazione ambientale.
- Corretta velocità di somministrazione.
Oggi è possibile gestire l’OPAT attraverso un processo domiciliare (Figura 3) e l’adozione di moderne tecnologie biomediche.
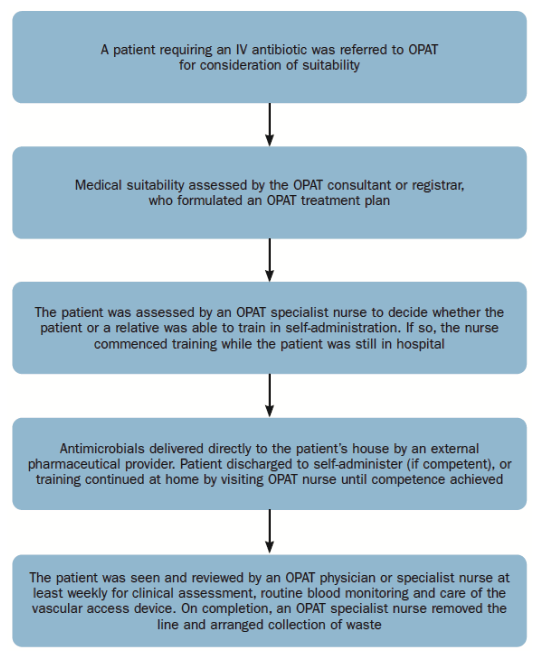
Fig. 3. Processo OPAT a domicilio
Con l’uso di queste tecnologie innovative, i pazienti/ caregiver che non sono in grado di miscelare gli antimicrobici in modo tradizionale, possono essere addestrati all’uso di dispositivi elastomerici riempiti asetticamente premiscelati da fornitori farmaceutici esterni.
Utilizzando dispositivi di infusione continua 24 ore su 24, gli antibiotici beta-lattamici come flucloxacillina, benzilpenicillina e piperacillina con tazobactam possono essere auto-somministrati dai pazienti stessi, evitando l’ospedale per tutta la durata della terapia.
Pazienti anziani o con problemi di destrezza, pazienti in regime complesso e multi-farmaco e quelli per i quali gli antibiotici beta-lattamici continui erano il trattamento preferito possono ora essere deospedalizzati fornendo loro un dispositivo elastomerico, che contiene un “palloncino” elastomerico: mentre questo si sgonfia nel tempo, spinge delicatamente l’antimicrobico attraverso il set per infusione endovenosa che trasporta il farmaco dal dispositivo al catetere/porta, fornendo una portata affidabile e accurata.
Tecnologie sanitarie digitali attuali e future per la gestione delle infezioni
Le moderne tecnologie digitali sono risorse preziose per affrontare la diffusione delle infezioni e sostenere il passaggio dall’ospedale alla casa del paziente.
L’implementazione di dispositivi digitali sia in ambito ospedaliero che domiciliare, può:
- Facilitare l’identificazione precoce del rischio di infezione e consentire un pronto intervento da parte del personale medico e infermieristico.
- Consentire una gestione più prudente degli antibiotici ad ampio spettro, prevenire più efficacemente la resistenza agli antibiotici e migliorare il tipo e i dosaggi della giusta terapia antimicrobica.
- Massimizzare la biosicurezza dell’ambiente.
- Garantire la governance dei servizi terapeutici erogati al territorio, grazie al monitoraggio in tempo reale delle performance.
Alcuni esempi di queste tecnologie sono descritti nei paragrafi seguenti.
Piattaforma web per la sorveglianza delle infezioni
Fino a pochi anni fa, le attività di sorveglianza delle infezioni erano svolte da équipe mediche interdisciplinari che analizzavano i dati estratti da vari sistemi informativi ospedalieri come ad esempio, la cartella clinica elettronica e/o il sistema informativo di laboratorio (LIS).
Oggi, l’emergenza sanitaria legata alle infezioni ospedaliere causate dalla resistenza agli antibiotici pone in primo piano le squadre di sorveglianza sanitaria, che hanno aumentato la necessità di un’estrazione automatizzata e più frequente di un numero crescente di dati clinici non omogenei.
I fornitori di sistemi di informazione medica sono in ritardo sull’innovazione nella sorveglianza delle infezioni, che ha portato molte organizzazioni sanitarie a dotarsi di strumenti specifici per la sorveglianza e il controllo avanzato delle infezioni 17.
Una specifica piattaforma di sorveglianza delle infezioni deve essere in grado di raccogliere in modo trasparente i dati da qualsiasi sistema informativo esistente all’interno di un’organizzazione sanitaria: registro di ammissione, dimissione e trasferimento del paziente, laboratorio di microbiologia, sale operatorie, apparecchiature mediche, radiologia, ecc.
I dati raccolti sono trattati mediante algoritmi in grado di rilevare immediatamente potenziali rischi quali:
- La presenza, in un determinato arco temporale, di due o più casi di microrganismo infettivo rilevati su pazienti ricoverati nello stesso reparto.
- La riammissione di un paziente che ha avuto una grave infezione nell’ultimo anno.
Al verificarsi di scenari di potenziale rischio di infezioni, il personale di sorveglianza viene tempestivamente avvisato in modo che possano essere adottate le opportune precauzioni per prevenire l’insorgere di cluster epidemici.
Inoltre, questi sistemi possono anche fornire un valido supporto nella gestione antimicrobica. Ad esempio, la prescrizione di un antibiotico ad ampio spettro potrebbe essere prontamente interrotta a favore di un farmaco mirato non appena il laboratorio genera un rapporto valido che conferma che è stato identificato uno specifico microrganismo patogeno.
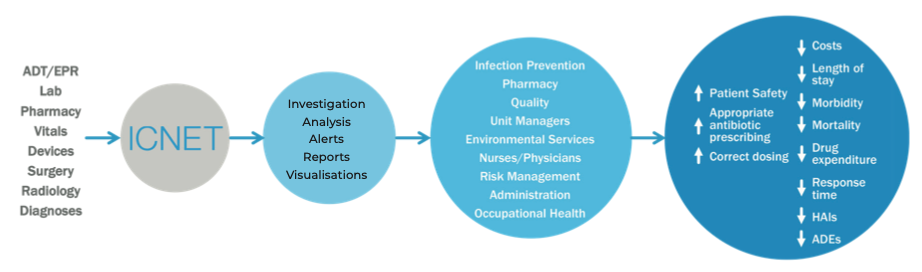
Fig. 4. Schema di funzionamento della piattaforma di sorveglianza delle infezioni ICNet
Tale piattaforma può portare grandi benefici all’interno di una struttura sanitaria, come la riduzione delle infezioni del sito chirurgico (SSI)18, la riduzione del carico di lavoro del team di sorveglianza delle infezioni 19, e ridurre in modo significativo la prescrizione di farmaci antibiotici ad ampio spettro 20 e l’uso di antibiotici in generale21.
L’adozione di una piattaforma specifica per la sorveglianza delle infezioni consente un maggior controllo nella gestione dei pazienti e, di conseguenza, favorisce il possibile spostamento dall’ospedale al territorio, ad esempio per curare i pazienti cronici e/o per la fase post-chirurgica.
Dispositivi per la sanificazione dei locali con tecnologia illuminotecnica
Pur fornendo terapie a domicilio del paziente fornisce tutti i vantaggi descritti nei paragrafi precedenti, l’ambiente domestico potrebbe non essere in grado di garantire condizioni di biosicurezza adeguate. Per questo motivo, nel caso di pazienti particolarmente delicati o critici, potrebbe essere utile adottare un sistema che consenta la continua sanificazione degli ambienti.
Alcune tecnologie molto promettenti sono state sviluppate sulla base del concetto di sanificazione continua utilizzando frequenze di luce visibile, senza emissione di radiazioni ionizzanti zero, che, mentre illuminano gli ambienti, li sanificano continuamente. Queste tecnologie sono progettate per fornire sanificazione senza sterilizzare l’ambiente e controllare la proliferazione di batteri e virus che agiscono in sinergia con la naturale resilienza del sistema immunitario umano.
Questa tecnologia si basa sulle seguenti premesse22:
- Evitare la “ricontaminazione”. La “ricontaminazione” è il ristabilimento di una popolazione microbica potenzialmente patogena in ambienti che sono stati precedentemente trattati con disinfettanti chimici; come si può facilmente immaginare, una volta che una superficie o un ambiente è stato trattato attraverso sistemi di sanificazione fisica o chimica, è inevitabile che venga ricontaminato non appena gli esseri viventi iniziano a visitarlo.
- Contrastare il fenomeno del “resistome” (il resistome è il materiale genetico scambiato tra microrganismi che permette l’acquisizione di informazioni genetiche favorendo la resistenza agli antibiotici). L’uso sconsiderato di disinfettanti e antibiotici favorisce la fissazione in diverse popolazioni di microrganismi e mutazioni che li proteggono a discapito di quelli sensibili. In questo modo occupano spazi abitativi sempre più ampi e diventano fissi.
- Concetto di antagonismo competitivo. Non elimina tutti i microrganismi in modo incontrollato, ma, mentre elimina i germi patogeni, favorisce la creazione di colonie stabili di “probiotici”.
- La tecnologia è “personalizzabile”, può essere calibrata per garantire l’efficacia richiesta da ambienti con diversi livelli di rischio microbiologico.
Questa tecnologia è risultata efficace su diversi tipi di batteri GRAM+ e GRAM-, virus (tra cui SARS-Cov-2), funghi, spore e muffe, sia nei test in vitro che in vivo 23.
La semplice sostituzione delle luci con questo tipo di dispositivo permetterà di aumentare il livello di biosicurezza degli ambienti, riducendo gli eventuali rischi residui di contaminazione e massimizzandone l’efficacia.
Inoltre, queste tecnologie possono essere integrate con sensori IoT alimentati sulla rete Ethernet (PoE = Power over Ethernet) che offrono i seguenti vantaggi:
- Connessione a bassa tensione, facile installazione.
- Integra la tecnologia della luce igienizzante sopra descritta.
- Rilevazione di presenza, temperatura, umidità, VOC (Volatile Organic Compound), luce ambientale, CO2.
- Integrare le spie luminose per supportare molti casi di utilizzo.
- Permettono di identificare e mostrare il livello di occupazione di una stanza, definire i cicli di sanificazione, gestire percorsi clinici e alert.
Orchestrazione del processo sanitario
Ogni qualvolta si trasferisce un percorso clinico dall’ospedale al territorio, è necessario adottare strumenti che ne garantiscano la governance, ovvero strumenti che consentano un’esecuzione efficace e tempestiva, e sincronizzino le attività tra tutti gli operatori coinvolti, aumentandone l’efficienza.
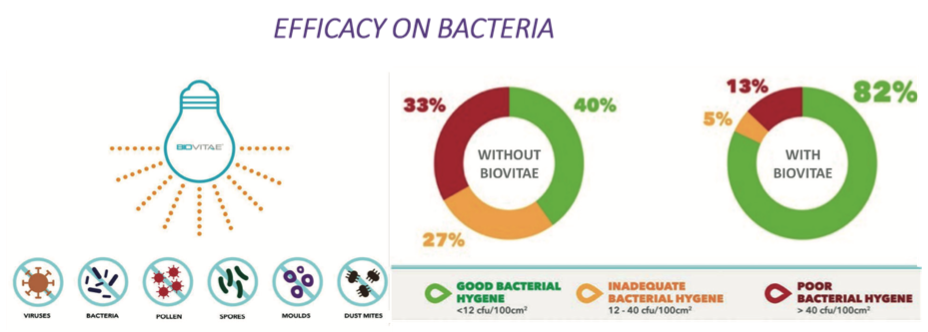
Fig. 5. Risultati dell’applicazione di luci Biovitae sui batteri.
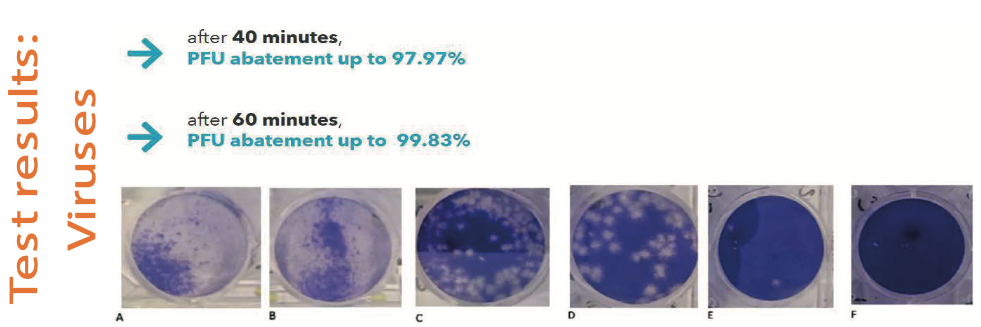
Fig. 6. Risultati dell’applicazione di luci Bioviae sui virus.
Questo livello di sincronizzazione – o “orchestrazione” – è raggiungibile grazie all’utilizzo di layer tecnologici già oggi disponibili:
- Un repository comune dove aggregare tutti i dati clinici raccolti.
- Uno schema semantico comune che garantisca la manutenzione dei dati durante le interazioni tra tutti gli operatori e i sistemi coinvolti.
- Un mezzo attraverso il quale i vari sistemi informativi sono in grado di condividere non solo dati e informazioni, ma anche elementi contestuali come eventi e metadati (cioè dati relativi a dati che forniscono descrizione del contesto).
- La descrizione delle interazioni tra tutti gli operatori coinvolti attraverso una notazione standard che consente una corretta ed accurata descrizione del processo e la sua implementazione e sincronizzazione.
Attraverso questo approccio24, sarà possibile implementare uno strumento centralizzato e integrato attraverso il quale prendersi cura dei pazienti domiciliari: una volta inquadrato un paziente in uno dei possibili percorsi di assistenza domiciliare, sarà sufficiente creare una nuova istanza del percorso orchestrato appropriato e tutti i sistemi e gli operatori coinvolti saranno tempestivamente e tempestivamente informati su ciò che ci si aspetta da loro.
Inoltre, sarà possibile analizzare in tempo reale le performance di processo: sarà possibile individuare eventuali colli di bottiglia, misurare i tempi di esecuzione di ciascun percorso e misurare costantemente specifici Key Performance Indicator (KPI) per accertare che il servizio erogato sia in linea con i requisiti.
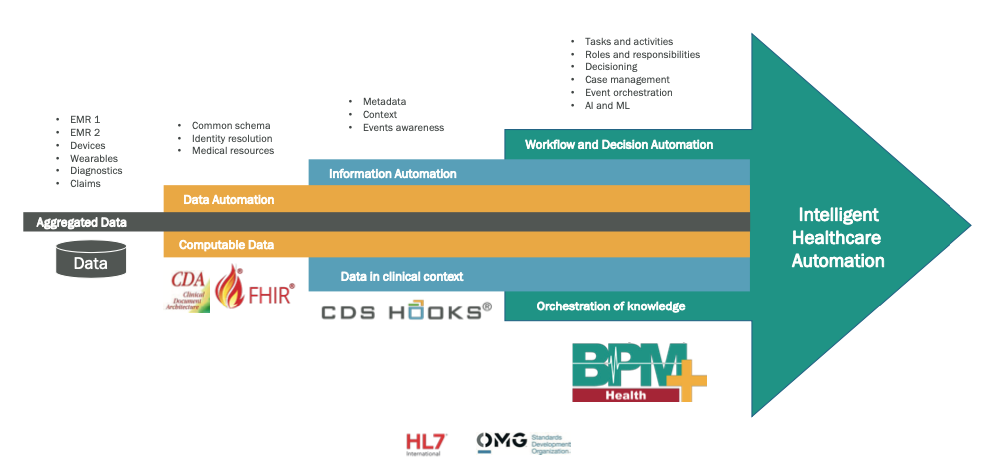
Fig. 7. Strati digitali che compongono un sistema intelligente di automazione sanitaria.
Conclusioni
Le malattie infettive possono essere controllate, e si spera prevenute, attraverso l’attuazione di programmi globali di sorveglianza ed educativi nelle strutture sanitarie e la creazione di consapevolezza nella popolazione generale.
n inoltre, un chiaro investimento globale, lo sviluppo e l’adozione di tecnologie digitali possono supportare il sistema sanitario mondiale e i fornitori di assistenza sanitaria per ridurre/gestire le HAI e, al contempo, aumentare/garantire grammi a persone ben istruite/allargate già disponibili oggi: prevenire/controllare le infezioni, l’accesso ai pazienti con progressione dell’assistenza domiciliare.
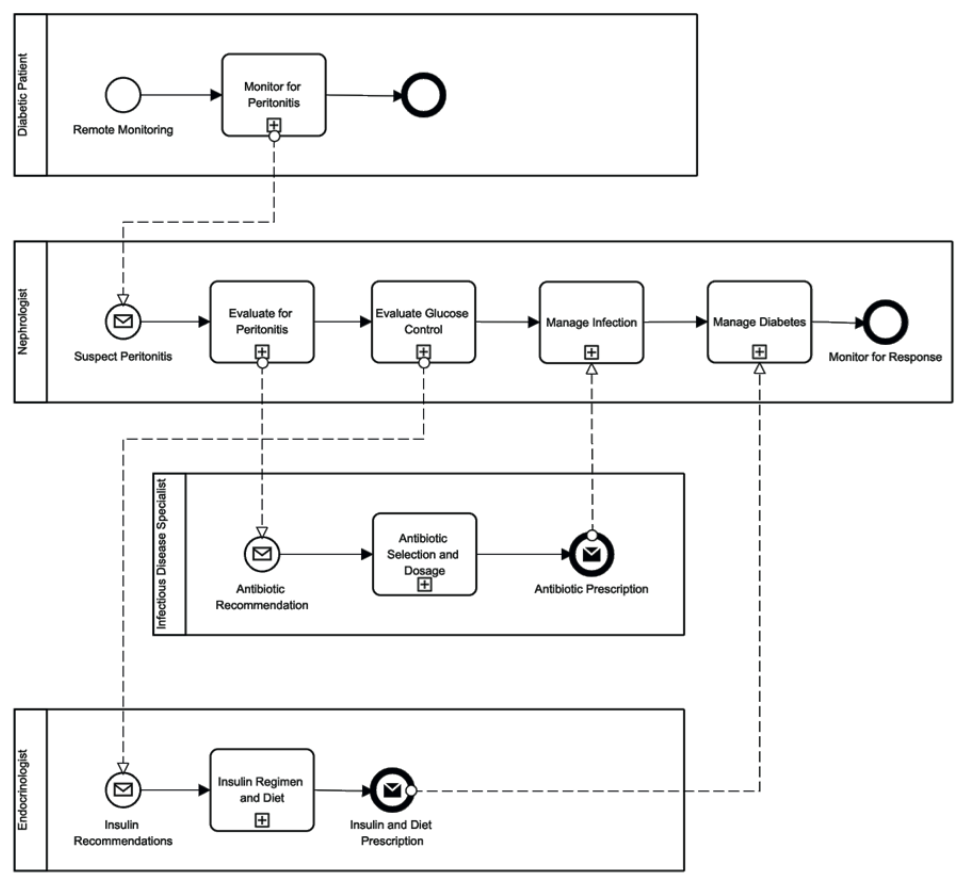
Fig. 8. Il modello BPMN del percorso sanitario si è concentrato sui pazienti diabetici arruolati in un programma APD.